Expo
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
Imagenología
Cuidados CriticosTéc. QuirúrgicaCuidados de PacientesTIPruebas POCNegocios
Eventos
Webinars

- Estetoscopio con IA detecta enfermedad de las válvulas cardíacas antes que los médicos
- Nuevo dispositivo de pulverización en niebla administra antibióticos directamente en tejido infectado
- Parche portátil ofrece lecturas actualizadas de los niveles de medicación en el cuerpo
- Implante vivo podría eliminar las inyecciones diarias de insulina
- Sistema de cámara inteligente monitorea continuamente a bebés prematuros en la UCIN
- Innovación quirúrgica reduce el riesgo de cáncer de ovario en un 80%
- Nueva combinación de técnicas de imagen brinda esperanza a pacientes cardíacos de alto riesgo
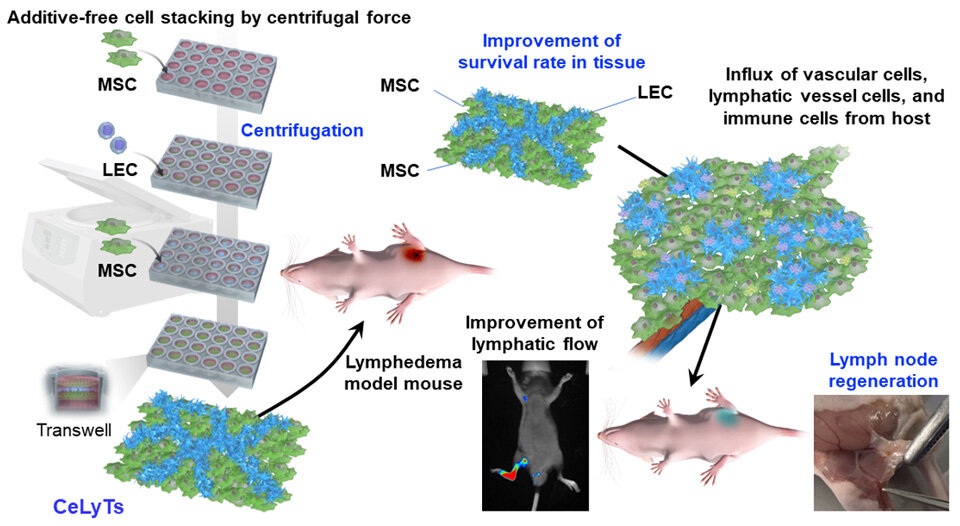
- Tejido bioingenierizado ofrece nueva esperanza para el tratamiento del linfedema secundario
- Catéter de energía dual aporta nueva flexibilidad a la ablación de la fibrilación auricular
- Sonda pionera permite monitorizar la salud fetal in utero durante la cirugía
- Herramienta de capacitación en realidad virtual combate la contaminación de equipos médicos portátiles
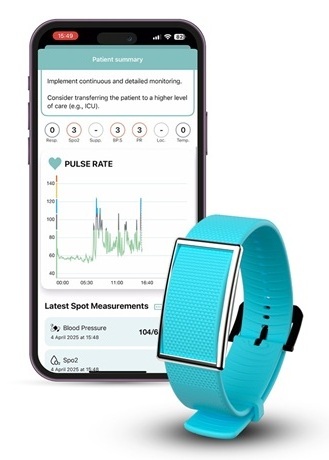
- Plataforma de biosensores portátiles reducirá infecciones adquiridas en el hospital
- Tecnología portátil de luz germicida, única en su tipo, desinfecta superficies clínicas de alto contacto en segundos
- Solución de optimización de la capacidad quirúrgica ayuda a hospitales a impulsar utilización de quirófanos
- Innovación revolucionaria en esterilización de instrumentos quirúrgicos mejora significativamente rendimiento del quirófano
- B. Braun adquiere la empresa de microcirugía digital True Digital Surgery
- Bayer y el Instituto Broad amplían su colaboración para desarrollar nuevas terapias cardiovasculares
- Medtronic se asocia con Corsano para ampliar su portafolio de atención aguda y monitorización en Europa
- Colaboración ampliada transformará la tecnología en quirófanos mediante IA y automatización
- Boston Scientific adquiere la empresa de dispositivos médicos SoniVie
- Nanopartículas imprimibles permiten la producción masiva de biosensores portátiles
- Los relojes inteligentes podrían detectar la insuficiencia cardíaca congestiva
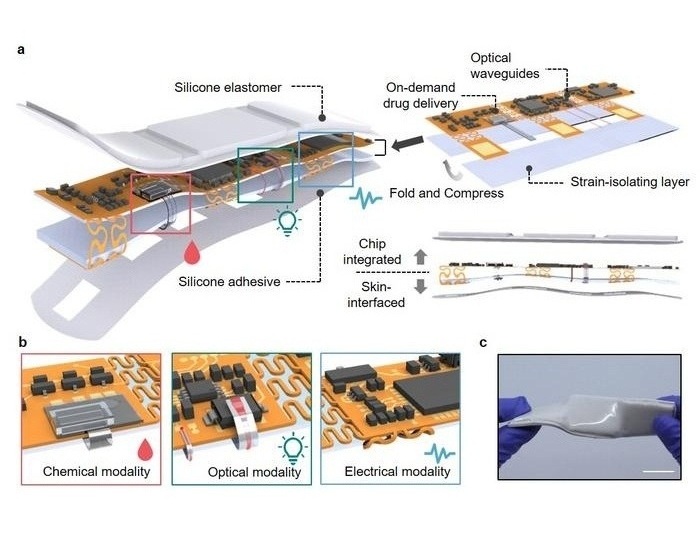
- Un parche inteligente versátil combina monitoreo de salud y administración de fármacos
- Modelo de aprendizaje automático mejora predicción del riesgo de mortalidad para pacientes de cirugía cardíaca
- Colaboración estratégica para desarrollar e integrar IA generativa en el cuidado de la salud
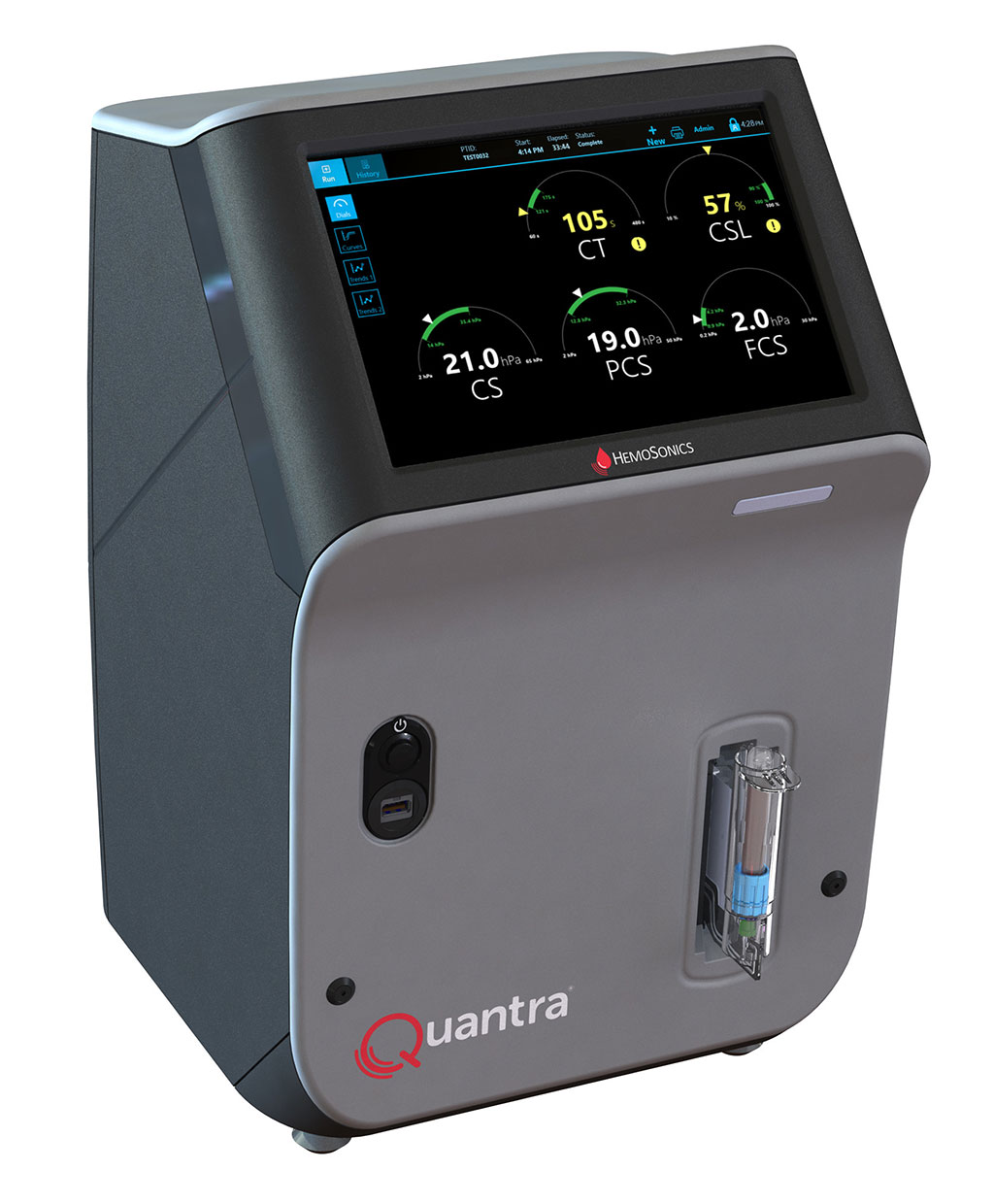
- Sistema de hemostasia de sangre total POC de última generación reconoce necesidades específicas de servicios de emergencia y quirófanos
- Laboratorio portátil permitirá identificación de infecciones bacterianas más rápida y económica en el punto de necesidad
- Mercado mundial de pruebas de cabecera será testigo de perspectivas prometedoras en cuidados intensivos
- Mercado mundial de diagnóstico de sepsis impulsado por el aumento de enfermedades adquiridas en hospitales

 Expo
Expo
- Estetoscopio con IA detecta enfermedad de las válvulas cardíacas antes que los médicos
- Nuevo dispositivo de pulverización en niebla administra antibióticos directamente en tejido infectado
- Parche portátil ofrece lecturas actualizadas de los niveles de medicación en el cuerpo
- Implante vivo podría eliminar las inyecciones diarias de insulina
- Sistema de cámara inteligente monitorea continuamente a bebés prematuros en la UCIN
- Innovación quirúrgica reduce el riesgo de cáncer de ovario en un 80%
- Nueva combinación de técnicas de imagen brinda esperanza a pacientes cardíacos de alto riesgo
- Tejido bioingenierizado ofrece nueva esperanza para el tratamiento del linfedema secundario
- Catéter de energía dual aporta nueva flexibilidad a la ablación de la fibrilación auricular
- Sonda pionera permite monitorizar la salud fetal in utero durante la cirugía
- Herramienta de capacitación en realidad virtual combate la contaminación de equipos médicos portátiles
- Plataforma de biosensores portátiles reducirá infecciones adquiridas en el hospital
- Tecnología portátil de luz germicida, única en su tipo, desinfecta superficies clínicas de alto contacto en segundos
- Solución de optimización de la capacidad quirúrgica ayuda a hospitales a impulsar utilización de quirófanos
- Innovación revolucionaria en esterilización de instrumentos quirúrgicos mejora significativamente rendimiento del quirófano
- B. Braun adquiere la empresa de microcirugía digital True Digital Surgery
- Bayer y el Instituto Broad amplían su colaboración para desarrollar nuevas terapias cardiovasculares
- Medtronic se asocia con Corsano para ampliar su portafolio de atención aguda y monitorización en Europa
- Colaboración ampliada transformará la tecnología en quirófanos mediante IA y automatización
- Boston Scientific adquiere la empresa de dispositivos médicos SoniVie
- Nanopartículas imprimibles permiten la producción masiva de biosensores portátiles
- Los relojes inteligentes podrían detectar la insuficiencia cardíaca congestiva
- Un parche inteligente versátil combina monitoreo de salud y administración de fármacos
- Modelo de aprendizaje automático mejora predicción del riesgo de mortalidad para pacientes de cirugía cardíaca
- Colaboración estratégica para desarrollar e integrar IA generativa en el cuidado de la salud
- China aprueba la primera vacuna inhalable contra la COVID-19 del mundo
- Vacuna en parche contra la COVID-19 combate variantes del SARS-CoV-2 mejor que las agujas
- Pruebas de viscosidad sanguínea predicen riesgo de muerte en pacientes hospitalizados con COVID-19
- ‘Computadora Covid’ usa IA para detectar COVID-19 en exámenes de TC de tórax
- Técnica de resonancia magnética muestra la causa de los síntomas de COVID prolongada
- Sistema de hemostasia de sangre total POC de última generación reconoce necesidades específicas de servicios de emergencia y quirófanos
- Laboratorio portátil permitirá identificación de infecciones bacterianas más rápida y económica en el punto de necesidad
- Mercado mundial de pruebas de cabecera será testigo de perspectivas prometedoras en cuidados intensivos
- Mercado mundial de diagnóstico de sepsis impulsado por el aumento de enfermedades adquiridas en hospitales