Expo
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
Imagenología
Cuidados CriticosTéc. QuirúrgicaCuidados de PacientesTIPruebas POCNegocios
Eventos

- Dispositivo electrónico portátil súper permeable permite monitorear bioseñales a largo plazo
- Nuevo hidrogel con capacidades mejoradas para tratar aneurismas y detener su progresión
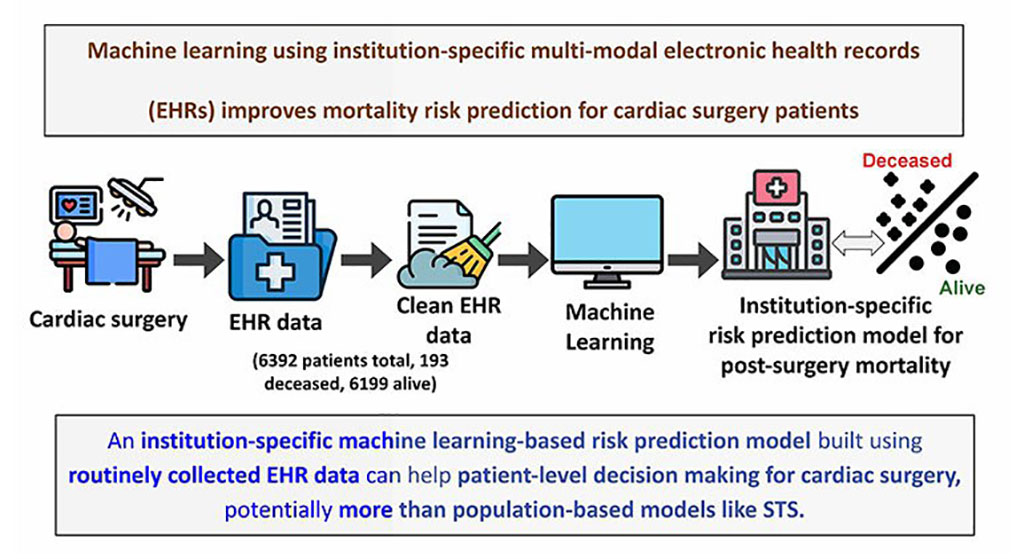
- Nueva herramienta de IA predice eventos médicos para respaldar toma de decisiones clínicas en entornos de atención médica
- El magnetómetro de un teléfono inteligente utiliza hidrogel magnetizado para medir biomarcadores para el diagnóstico de enfermedades
- Malla bioelectrónica crece con tejidos cardíacos para monitorización cardíaca integral
- Tecnología de balón magnético optimiza resultados del procedimiento de colonoscopia
- Sistema de cirugía robótica con capacidad basada en visión por computadora allana el camino para laparoscopia de próxima generación
- Simple protocolo de prevención puede reducir infecciones peligrosas del sitio quirúrgico
- Nuevos implantes inteligentes podrían monitorear continuamente y promover activamente la curación ósea
- Sistema de endoscopia en la nube permite procesamiento de imágenes en tiempo real en la nube
- Innovación revolucionaria en esterilización de instrumentos quirúrgicos mejora significativamente rendimiento del quirófano
- Cama para UCI de próxima generación ayuda a abordar necesidades complejas de cuidados intensivos
- Innovadora tecnología de desinfección UV-C impulsada por IA redefine el panorama del control de infecciones
- Hospitales limpios pueden reducir la resistencia a los antibióticos y salvar vidas
- Camas inteligentes para hospital mejoran la precisión del diagnóstico médico
- Olympus adquiere fabricante coreano de stents gastrointestinales Taewoong Medical
- Karl Storz adquiere especialista británico en IA Innersight Labs
- Stryker adquirirá la empresa francesa de reemplazo de articulaciones SERF SAS
- Medical Illumination adquiere el especialista en iluminación quirúrgica Isolux
- Robots 5G controlados remotamente permitirían incluso cirugías transfronterizas
- Colaboración estratégica para desarrollar e integrar IA generativa en el cuidado de la salud
- Solución de quirófanos habilitada para IA ayuda a hospitales a maximizar la utilización y desbloquear la capacidad
- IA predice cáncer de páncreas tres años antes del diagnóstico a partir de registros médicos de los pacientes
- Primer sistema de autorizaciones médicas personalizadas de IA generativa totalmente autónoma reduce el retraso en la atención
- Según un estudio, registros médicos electrónicos pueden ser clave para mejorar la atención al paciente
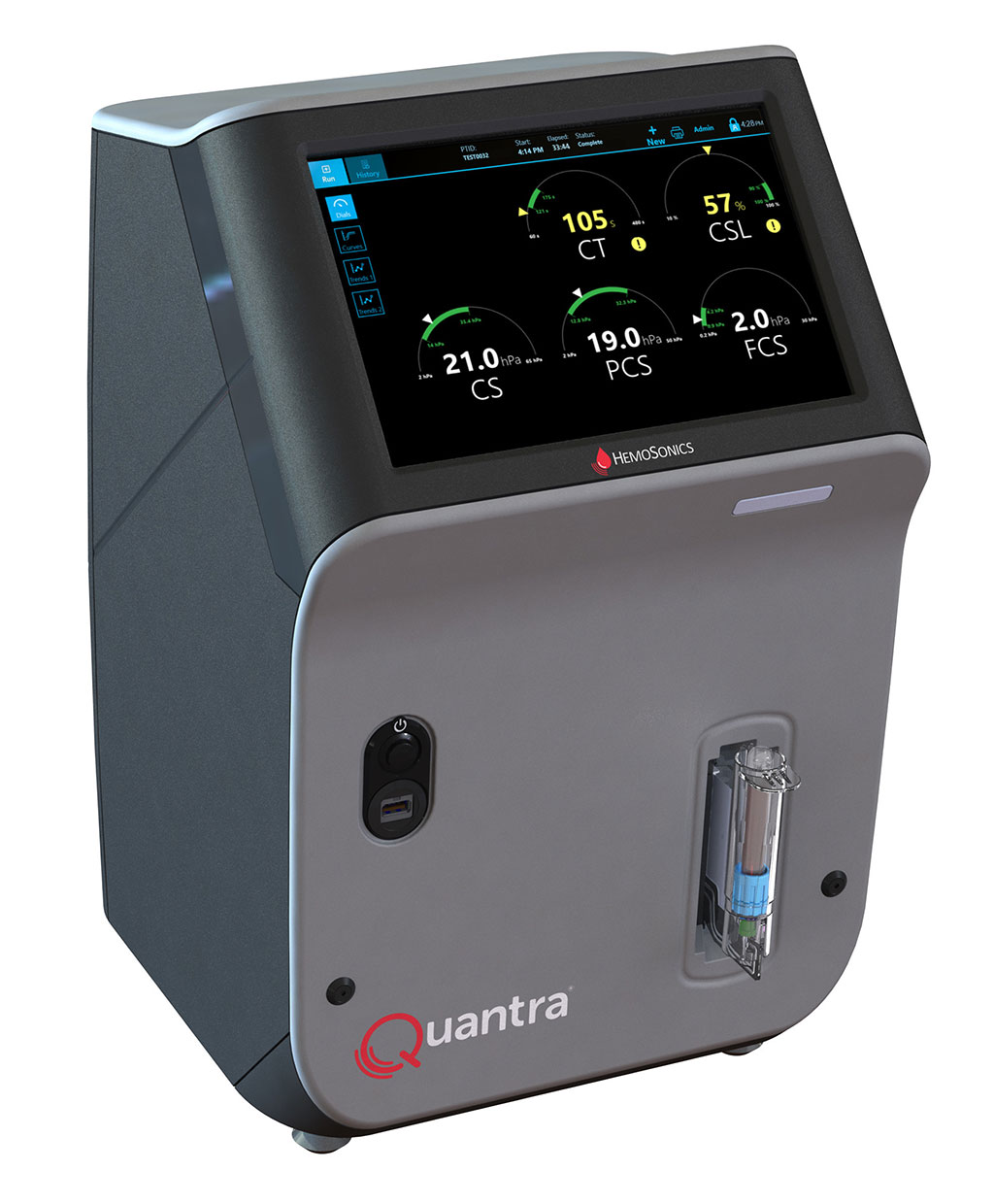
- Sistema de hemostasia de sangre total POC de última generación reconoce necesidades específicas de servicios de emergencia y quirófanos
- Laboratorio portátil permitirá identificación de infecciones bacterianas más rápida y económica en el punto de necesidad
- Mercado mundial de pruebas de cabecera será testigo de perspectivas prometedoras en cuidados intensivos
- Mercado mundial de diagnóstico de sepsis impulsado por el aumento de enfermedades adquiridas en hospitales

Expo
 ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
Imagenología
Cuidados CriticosTéc. QuirúrgicaCuidados de PacientesTIPruebas POCNegocios
Eventos
Publique su anuncio con nosotros
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
Imagenología
Cuidados CriticosTéc. QuirúrgicaCuidados de PacientesTIPruebas POCNegocios
Eventos
Publique su anuncio con nosotros


- Dispositivo electrónico portátil súper permeable permite monitorear bioseñales a largo plazo
- Nuevo hidrogel con capacidades mejoradas para tratar aneurismas y detener su progresión
- Nueva herramienta de IA predice eventos médicos para respaldar toma de decisiones clínicas en entornos de atención médica
- El magnetómetro de un teléfono inteligente utiliza hidrogel magnetizado para medir biomarcadores para el diagnóstico de enfermedades
- Malla bioelectrónica crece con tejidos cardíacos para monitorización cardíaca integral
- Tecnología de balón magnético optimiza resultados del procedimiento de colonoscopia
- Sistema de cirugía robótica con capacidad basada en visión por computadora allana el camino para laparoscopia de próxima generación
- Simple protocolo de prevención puede reducir infecciones peligrosas del sitio quirúrgico
- Nuevos implantes inteligentes podrían monitorear continuamente y promover activamente la curación ósea
- Sistema de endoscopia en la nube permite procesamiento de imágenes en tiempo real en la nube
- Innovación revolucionaria en esterilización de instrumentos quirúrgicos mejora significativamente rendimiento del quirófano
- Cama para UCI de próxima generación ayuda a abordar necesidades complejas de cuidados intensivos
- Innovadora tecnología de desinfección UV-C impulsada por IA redefine el panorama del control de infecciones
- Hospitales limpios pueden reducir la resistencia a los antibióticos y salvar vidas
- Camas inteligentes para hospital mejoran la precisión del diagnóstico médico
- Olympus adquiere fabricante coreano de stents gastrointestinales Taewoong Medical
- Karl Storz adquiere especialista británico en IA Innersight Labs
- Stryker adquirirá la empresa francesa de reemplazo de articulaciones SERF SAS
- Medical Illumination adquiere el especialista en iluminación quirúrgica Isolux
- Robots 5G controlados remotamente permitirían incluso cirugías transfronterizas
- Colaboración estratégica para desarrollar e integrar IA generativa en el cuidado de la salud
- Solución de quirófanos habilitada para IA ayuda a hospitales a maximizar la utilización y desbloquear la capacidad
- IA predice cáncer de páncreas tres años antes del diagnóstico a partir de registros médicos de los pacientes
- Primer sistema de autorizaciones médicas personalizadas de IA generativa totalmente autónoma reduce el retraso en la atención
- Según un estudio, registros médicos electrónicos pueden ser clave para mejorar la atención al paciente
- China aprueba la primera vacuna inhalable contra la COVID-19 del mundo
- Vacuna en parche contra la COVID-19 combate variantes del SARS-CoV-2 mejor que las agujas
- Pruebas de viscosidad sanguínea predicen riesgo de muerte en pacientes hospitalizados con COVID-19
- ‘Computadora Covid’ usa IA para detectar COVID-19 en exámenes de TC de tórax
- Técnica de resonancia magnética muestra la causa de los síntomas de COVID prolongada
- Sistema de hemostasia de sangre total POC de última generación reconoce necesidades específicas de servicios de emergencia y quirófanos
- Laboratorio portátil permitirá identificación de infecciones bacterianas más rápida y económica en el punto de necesidad
- Mercado mundial de pruebas de cabecera será testigo de perspectivas prometedoras en cuidados intensivos
- Mercado mundial de diagnóstico de sepsis impulsado por el aumento de enfermedades adquiridas en hospitales